4. DETERMINAREA CALDURILOR SPECIFICE ALE
SUBSTANTELOR GAZOASE
4.1. Notiuni generale
Cantitatea de caldura necesara pentru ridicarea temperaturii unui corp cu un grad poarta denumirea de capacitate calorica. Capacitatea calorica a unui corp este un parametru extensiv, depinzand de masa si natura acestuia. Capacitatea calorica a unitatii de cantitate de substanta se numeste caldura specifica sau capacitate calorica specifica. Valoarea ei nu depinde de cantitatea de substanta, fiind o proprietate intensiva a corpurilor.
Caldura specifica c, sau capacitatea calorica specifica, a unei substante omogene, reprezinta energia termica necesara unitatii de cantitate din acea substanta pentru a-si mari temperatura cu un grad fara ca procesul sa produca o schimbare de faza sau de stare de agregare. Cantitatea de caldura schimbata de un corp de masa m in intervalul de temperatura (T1 - T2) este data de relatia:
![]()
![]() Q12 = m×
Q12 = m×
![]() ×
( T2 – T1) [ J ], (4.1)
×
( T2 – T1) [ J ], (4.1)
de unde rezulta expresia caldurii specifice:
![]() [J / (kg×
K)] (4.2)
[J / (kg×
K)] (4.2)
Potrivit relatiei (4.2) caldura specifica este o marime care depinde de unitatea de cantitate de substanta, de intervalul de temperatura si de natura procesului termic.
Din punct de vedere a unitatii de cantitate de substanta luata in considerare, caldurile specifice utilizate in tehnica, pot fi:
a) calduri specifice masice, c, in J / (kg× K) ;
b) calduri specifice raportate la metru cub normal, cN, in J /(m3N× K) ;
c) calduri specifice molare, CM , in J /( kmol× K).
Caldura specifica raportata la unitatea de volum c’, [J /(m3× K)], este utilizata foarte rar in aplicatiile practice.
Relatiile intre aceste tipuri de calduri specifice sunt:
CM = M× c = VM × cN [J / (kmol× K) ], (4.3)
unde: M este masa moleculara a substantei [ kg/kmol] ,
VM = 22,414 - volumul molar [ m3N/kmol] ,
c N = r N × c [J / (m3N.K)], (4.4)
unde: r N este masa specifica a substantei in conditii normale, in kg/m3N .
Din punct de vedere al intervalului de temperatura, caldurile specifice pot fi:
a) calduri specifice reale sau instantanee, c, cN, CM;
b) calduri specifice medii, ![]()
Din punct de vedere a naturii transformarii realizata de substanta, pentru practica prezinta interes urmatoarele calduri specifice:
a) calduri specifice la presiune constanta, ![]() , cNp, CMp,
, cNp, CMp,
![]() ;
;
b) calduri specifice la volum constant , cv, cNv , Cmv ,![]() ,
,
![]()
Dependenta dintre caldurile specifice este data de relatiile lui Robert
Mayer:
- pentru gazul perfect:
cp - cv = R [J / (kg× K)]; (4.5)
- pentru gazele reale:
![]() [J / (kg×
K) ]; (4.6)
[J / (kg×
K) ]; (4.6)
unde:
R este constanta particulara a gazului perfect, in J / (kg× K) ;
![]()
![]() - coeficientul real de dilatare volumica, in grd-1;
- coeficientul real de dilatare volumica, in grd-1;
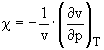 - coeficientul de compresibilitate termica, in Pa-1.
- coeficientul de compresibilitate termica, in Pa-1.
La corpurile solide si lichide are importanta practica numai caldura specifica la presiune constanta, ![]() . La corpurile gazoase cp se determina experimental iar caldura specifica la volum constant, cV, rezulta prin calcul folosind relatiile (4.5) si (4.6).
. La corpurile gazoase cp se determina experimental iar caldura specifica la volum constant, cV, rezulta prin calcul folosind relatiile (4.5) si (4.6).
4.2. Descrierea instalatiei si mersul lucrarii
In figura 4.1 este reprezentata schematic instalatia cu ajutorul careia se determina caldura specifica a substantelor gazoase, a gazului metan in cazul prezentei lucrari. Fig.4.1. Instalatia pentru determinarea caldurii specifice a gazului metan.
Instalatia se compune din schimbatorul de caldura 1, calorimetrul 2, si contorul de gaz metan 3.
In serpentina schimbatorului de caldura 1, gazul metan primeste caldura de la fluidul calorimetric aflat in interiorul acestuia care este incalzit cu ajutorul arzatorului 4.
Temperatura ti si volumul V ale gazului metan la intrarea in schimbatorul de caldura 1, se determina cu termometrul cu lichid 5 si contorul 3.
La intrarea in calorimetrul 2 se masoara presiunea statica pst cu manometrul cu lichid 6 si temperatura t1 cu termometrul 7.
In calorimetrul 2, gazul metan cedeaza caldura ansamblului calorimetric. Temperatura t2 a acestuia la iesirea din calorimetru se masoara
cu termometrul 8.
Temperatura initiala to si finala t a apei din calorimetru se determina cu termometrul de precizie 9, citirea efectuandu-se prin intermediul unei lupe 10. Pentru uniformizarea temperaturii apei din calorimetru se foloseste agitatorul 11 antrenat de motorul electric 12.
Caldura specifica la presiune constanta ![]() a gazului metan se determina considerand calorimetrul 2 ca incinta adiabatica. Ecuatia calorimetrica a acestuia este:
a gazului metan se determina considerand calorimetrul 2 ca incinta adiabatica. Ecuatia calorimetrica a acestuia este:
Q1 = Q2 [J] , (4.7)
unde:
Q1 este cantitatea de caldura cedata de gaz ansamblului calorimetric, in J;
Q2 - cantitatea de caldura primita de elementele calorimetrului, in J.
Cantitatile de caldura a1 si a2 se determina cu relatiile:
![]() [J ] , (4.8)
[J ] , (4.8)
![]() [ J ] , (4.9)
[ J ] , (4.9)
unde:
m este cantitatea de gaz metan care trece prin calorimetru, in kg;
![]() - caldura specifica la presiunea constanta medie, in J / (kg×
K);
- caldura specifica la presiunea constanta medie, in J / (kg×
K);
t1, t2 - temperatura gazului metan la intrare respectiv la iesire din calorimetru, in oC;
mi - masa componentului i al ansamblului calorimetric, in kg;
![]() - caldura specifica la presiune constanta, medie, a componentului i al ansamblului calorimetric, in J / (kg×
K);
- caldura specifica la presiune constanta, medie, a componentului i al ansamblului calorimetric, in J / (kg×
K);
to, t - temperatura initiala respectiv finala a apei din calorimetru in oC.
in relatia (4.9) ![]() se noteaza cu C si poarta denumirea de capacitate calorica a calorimetrului:
se noteaza cu C si poarta denumirea de capacitate calorica a calorimetrului:
![]() [ J / K ] . (4.10)
[ J / K ] . (4.10)
Din relatiile de mai sus rezulta:
![]() [ J / (kg×
K) ] . (4.11)
[ J / (kg×
K) ] . (4.11)
Cantitatea de gaz metan ce trece prin instalatie se determina cu relatia:
m = r N× VN , [ kg ] , (4.12)
in care:
![]() [m3N ] , (4.13)
[m3N ] , (4.13)
unde: r N este masa specifica a gazului metan la starea normala, in kg/m3N;
V - volumul de gaz la starea de masurare determinat cu ajutorul contorului 3, in m3;
VN - volumul de gaz metan redus la starea normala, in m3N;
TN = 273,16 K - temperatura la starea normala, in K;
Ti = ti + 273,16 - temperatura gazului metan la starea de masurare, in K;
pst - presiunea statica a gazului metan la starea de masurare, in Pa;
pb - presiunea barometrica, in Pa;
pN = 101325 Pa - presiunea la starea normala, in Pa.
Marimile masurate si calculate se centralizeaza in tabelul 4.1.
Tabelul 4.1 Valori masurate si calculate
|
Nr. |
M a r i m e a |
Simbol |
U.M. |
V a l o r i |
|||
|
crt. |
1 |
2 |
3 |
media |
|||
|
1. |
Temperatura medie a gazului metan la intrare |
t1 |
o C |
||||
|
2. |
Temperatura medie a gazului la iesire |
t2 |
o C |
||||
|
3. |
Temperatura initiala a apei |
to |
o C |
||||
|
4. |
Temperatura finala a apei |
t |
o C |
||||
|
5. |
Masa specifica a gazului metan la starea normala |
r N |
kg/m3N |
||||
|
6. |
Presiunea barometrica |
pb |
Pa |
||||
|
7. |
Suprapresiunea gazului |
pst |
Pa |
||||
|
8. |
Temperatura gazului me- tan la starea de masurare |
Ti |
K |
||||
Tabelul 4.1 Continuare,
|
Nr. |
M a r i m e a |
Simbol |
U.M. |
V a l o r i |
|||
|
crt. |
1 |
2 |
3 |
media |
|||
|
9. |
Volumul de gaz metan la starea de masurare |
V |
m3 |
||||
|
10. |
Volumul de gaz metan redus la starea normala |
VN |
m3N |
||||
|
11. |
Cantitatea de gaz metan |
m |
kg |
||||
|
12. |
Capacitatea calorica a calorimetrului |
C |
J / K |
||||
|
13. |
Caldura specifica la presiune constanta |
|
J/(kg× K) |
||||
|
14. |
Constanta particulara a gazului perfect |
R |
J/(kg× K) |
||||
|
15. |
Caldura specifica la volum constant |
|
J/(kg× K) |
||||
|
16. |
Caldura specifica molara |
|
J/(kmol× K) |
||||
|
17. |
Exponentul adiabatic al gazului metan |
|
- |
||||